Neoplasie mammarie
I tumori mammari sono le neoplasie più frequenti nella cagna, con la loro prevalenza dello 0,2% e sono maligni in una percentuale che varia dal 41 al 53%. Molte caratteristiche epidemiologiche e cliniche, come il comportamento biologico, sono simili ai carcinomi mammari della donna, motivo per il quale i tumori del cane sono un ottimo modello di studio.
Alla base dello sviluppo ci sono complesse interazioni, non ancora del tutto chiarite, tra più fattori. I tumori possono essere influenzati da fattori interni dell’ospite, come la genetica, la razza, la dietà, e fattori esterni, che includono le contaminazioni ambientali.
Età. l’età media di insorgenza si aggira attorno agli 8 e 11 anni, con un aumento dell’incidenza già a 6 anni. Raramente sono colpiti animali più giovani dei 5 anni e solitamente si tratta di cani trattati con progestinici.
Ormonali. Le neoplasie mammarie sono ormonodipendenti: è stato infatti evidenziato un effetto protettivo dell’ovariectomia in giovanissima età e uno sviluppo di lesioni displasiche e neoplastiche in cagne trattate con progestinici. Studi clinici dimostrano che la sterilizzazione prima del primo calore riduce il rischio di sviluppare tumori alla mammella (a questo proposito, si rimanda però ad una lettura attenta degli effetti collaterali della sterilizzazione prima del primo calore). La neoplasia mammaria è rara nei maschio, in cui l’incidenza è stimata dello 0-2,7% e correlata alla secrezione anomala di estrogeni in presenza di neoplasia testicolare delle cellule di Sertoli.
Razza. Tutte le razze possono sviluppare questa patologia, ma alcune razze sembrano comparire maggiormente negli studi clinici, rilevando una certa correlazione tra incidenza tumorale e razza, lasciando spazio all’ipotesi che possa esistere una predisposizione genetica e quindi familiare. Sembra che le razze più colpite siano quelle di piccola e piccolissima taglia, come barboncino nano, maltese, chihuahua, beagle, dachsahund, West Highlnand White Terier, Yorkshire terrier, bichon frise, seguite da razze di taglia media come English Springer e Brittany spaniel, cocker spaniel, english setter, pointer, pastore tedesco. Bisogna però ricordare che la sovra o sottoraprresentazione di una razza dipende dalal composizione della popolazione canina della regione geografica dello studio fatto, ci sono dati discordanti riguardo l’effettiva esistenza di una predisposizione di razza.
Obesità. Secondo studi recenti, animali magri a 9-12 mesi di età hanno un minor rischio di sviluppare neoplasie.. Il rischio aumenta quando parliamo di animali obesi in giovane età.
Alterazioni genetiche. Sono numerose le alterazioni riscontrate nei tumori mammari canini, come l’attivazione di protoncogeni cellulari, disattivazione o perdita dei geni soppressori (come p53) e presenza di anormalità a livello di DNA nucleare.
Contaminazione ambientale. I piretroidi sono contaminanti ambientali largamente diffusi negli ultimii dieci anni. Sono utilizzati come pesticidi in agricoltura e antiparassitari negli animali domestici e da reddito. Questa diffusione è legata alla loro efficienza come pesticidi e la loro emivita relativamente breve. Negli umani e negli animali, i piretroidi sono realmente assorbiti dalla cute e dal tratto respiratorio e digerente. Una volta assorbiti, vengono distribuiti nei vari tessuti e si concentrano in particolar modo nel tessuto adiposo. In casi di tumore mammario sono stati ritrovati in concentrazioni elevate nel tessuto circostante, ma non è ancora ben chiarito il meccanismo patogenetico.
Il ruolo degli ormoni
Estrogeni e progesterone sono ormoni steroidei prodotti dalle ovaie a partire dalla pubertà.
Gli estrogeni sono i responsabili del comportamento estrale negli animali ciclici e, alla pubertò, dello sviluppo delle caratteristiche degli organi genitali femminili e delle strutture sessuali secondarie (conformazione dell’organismo, distribuzione dell’adipe, caratteristiche del mantello…). Essi hanno un’azione iperemica, iperplastica ed ipertrofica su tutto l’apparato riproduttore.
Il progesterone deriva il suo nome dalla sua funzione di preparazione e mantenimento della gravidanza. Viene prodotto dalle cellule del corpo luteo durante la fase luteinica ovarica sotto lo stimolo dell’LH divenendo l’ormone predominante durante la fase di diestro ed in gravidanza. Le sue azioni progestiniche (cioè a favore del mantenimento della gravidanza) sono la diminuzione della contrattilità spontanea delle cellule miometrali e la diminuzione della loro sensibilità all’ossitocina, un effetto immunosoppressivo nell’ambiente uterino, promuovere la formazione del tappo cervicale e portare a completo sviluppo la componente alveolare della ghiandola mammaria, mediante un’azione trofica complementare a quella degli estrogeni.
A livello mammario, questi due ormoni sono fondamentali per un corretto sviluppo e differenziazione del tessuto ghiandolare mammario. Dalla pubertà, gli estrogeni stimolano il sistema duttale rudimentale a proliferare per poi formare un albero complesso attraverso il tessuto adiposo ghiandolare. Il progesterone è responsabile dello sviluppo alveolare che avviene in gravidanza e in diestro.
Nella mammella normale e neoplastica sono presenti recettori per estrogeni, progesterone, fattore di crescita epidermico, prolattina, insulina, corticosteroidi e per altri ancora. La mammella subisce quindi un’influenza poliormonale molto complessa, anche se gli estrogeni sono gli ormoni più importanti.
La valutazione dello stato dei recettori rappresenta un parametro importante in medicina umana ai fini terapeutici e prognostici, ma in medicina veterinaria non è un esame di routine. Numerosi studi in medicina umana hanno dimostrato che l’espressione recettoriale nel tumore è inversamente correlata al grado di malignità e alla proliferazione cellulare. Secondo tali osservazioni, i tumori più differenziati subiscono il controllo regolatorio degli ormoni e proliferano di meno, mentre al progredire del tumore verso la malignità, la sua dipendenza ormonale diminuisce e la proliferazione cellulare aumenta.
Nella cagna la maggior parte dei tumori benigni o ben differenziati sono ER + (60-70% circa) e PR +, mentre quelli maligni sono tendenzialmente ER – (40-60%).
Sono numerosi i fattori che influenzano lo stato dei recettori:
- dimensione del tumore primitivo: la concentrazione di ER e PR tende a diminuire con l’aumentare del volume della neoplasia
- stato ormonale: le cagne in fase luteale hanno una più alta concentrazione di ER rispetto alle cagne ovariectomizzate o in anestro. Solamente i cani con neoplasia ER + traggono beneficio dall’ovarioisterectomia e dalla terapia ormonale; perciò la positività ai recettori per gli estrogeni ha significato prognostico favorevole, sia in termini di tasso di recidiva sia di sopravvivenza
- ulcerazione cutanea, metastasi linfonodali, età della cagna alla diagnosi sono fattori che fanno diminuire significativamente l’espressione dei recettori ER.
Ovariectomia e ovariosterectomia e ghiandola mammaria
Secondo lo studio di Schneider e collaboratori del 1969, le cagne sottoposte a ovariectomia o ovarioisterectomia prima del primo anno di età hanno un rischio dello 0,5 %di sviluppare neoplasie mammarie, tra il primo ed il secondo ciclo un rischio dell’8%, dopo il secondo ciclo del 26%; non vi è alcuna differenza di incidenza tra animali interi e quelli ovariectomizzati dopo il secondo anno di vita (Taylor et al., 1976). Questo ha fatto pensare che l’effetto benefico dell’asportazione delle gonadi femminili fosse di tipo dose-dipendente; l’effetto sarebbe chiaramente maggiore in quei pazienti con nessuna o minima esposizione agli ormoni ovarici e diminuirebbe rapidamente entro i primi 2 anni di vita.
Con percentuali minori, anche i pazienti non interi possono tuttavia sviluppare una neoplasia mammaria ed in molti studi non è stato registrato un maggior tempo di sopravvivenza di questi rispetto ai soggetti interi.
Esiste una relazione tra l’espressione recettoriale tumorale e lo stato ormonale della cagna: un ambiente povero di estrogeni (animale non intero) favorirebbe la crescita dei subcloni neoplastici ER -; un ambiente ricco di estrogeni (animale intero) favorirebbe i subcloni ER +. Secondo questa teoria quindi, un cane che rimane intatto fino all’escissione chirurgica della neoplasia avrebbe una maggior probabilità di avere un tumore ER + e quindi di poter godere dei benefici di una terapia ormonale. Al contrario, un animale che non ha mai subito l’azione degli estrogeni svilupperà più probabilmente tumori ormono-dipendenti.
Classificazione
Il 50 % dei tumori mammari della cagna sono maligni e tra questi, circa il 50% metastatizza per via linfatica ai linfonodi regionali, ai polmoni e, meno frequentemente, ai linfonodi sottolombari, al fegato, ai reni, alle ossa (vertebre lombosacrali, coste, estremità prossimali del femore e dell’omero), ai surreni, al cuore e al sistema nervoso centrale. Nella donna le metastasi più frequenti sono quelle epatiche e scheletriche e forse anche nella cagna quelle scheletriche sono più frequenti di quello che si pensa attualmente.
Può verificarsi il cosiddetto skip metastasis per quanto riguarda i linfonodi, ovvero il primo linfonodo drenante non è interessato mentre lo è quello successivo.
Nel tessuto mammario sono presenti varie popolazioni cellulari (epiteliali, mio epiteliali e connettivali) e da ognuna di essere può originare il tumore. Tra i tumori maligni, i più frequenti sono i carcinomi (80-90%) mentre i sarcomi sono molto meno frequenti.
I carcinomi derivano dall’epitelio ghiandolare o dal mioepitelio mentre i sarcomi originano dal connettivo intralobulare. I tumori mammari del cane derivano principalmente dagli alveoli lobulari e dai piccoli dotti, mentre solo raramente dai dotti interlobulari (carcinoma papillare) o dai dotti più grossi (carcinoma duttale).
La classificazione è complessa e i tumori possono essere classificati per caratteristiche istologiche, morfologiche o prognostiche.La classificazione che riportiamo (Organizzazione Mondiale della Sanità e dell’Amed Forces Institue for Pathology) comprende una descrizione morfologica descrittiva e elementi di natura prognostica.
Tumori maligni
- Carcinoma in situ (non infiltrante)
- Carcinoma complesso (tubulo papillare, solido)
- Carcinoma semplice (tubulare, papillare, tubulo papillare, solido, solido cribriforme, anaplastico)
- Carcinoma a cellule fusate (mio epitelioma maligno)
- Carcinoma squamo cellulare
- Carcinoma adenosquamoso
- Carcinoma mucinoso (o gelatinoso)
- Carcinoma ricco in lipidi (carcinoma secretorio)
- Sarcoma (fibrosarcoma, osteosarcoma, condrosarcoma, liposarcoma)
- Carcinosarcoma
Tumori benigni
- Adenoma semplice (tubulare, solido)
- Adenoma complesso
- Adenoma basalioide
- Fibroadenoma (a bassa cellularità, ad alta cellularità)
- Tumori misti benigni
- Papilloma duttale (semplice, complesso)
Tumori non classificati, Iperplasia/displasia mammaria
- Iperplasia duttale
- Iperplasia duttale atipica
- Iperplasia lobulare
- Cisti
- Ectasia duttale
- Fibrosi focale (fibrosclerosi)
- Ginecomastia
Presentazione clinica
I tumori mammari nel cane si presentano come noduli singoli o multipli, solitamente ben palpabili all’interno del parenchima mammario. A differenza della donna, la presenza di più noduli contemporaneamente si riscontra di frequente, fino al 66% dei casi. Questa condizione di multinodularità non sembra influir sulla sopravvivenza postoperatoria, a differenza della gatta dove si osserva un maggior rischio di decesso poiché le lesioni multiple sono spesso associate ad invasione linfatica.
Nella cagna le ghiandole più interessate sono le inguinali e le addominali caudali anche se la localizzazione non sembra rivestire un significato prognostico.
Al momento della visita, i noduli possono essere ulcerati o meno, fluttuanti o ben adesi e hanno dimensioni molto variabili. Il diametro tumorale è considerato un parametro importante visto che tumori più grandi hanno una maggior probabilità di rivelarsi maligni all’esame istopatologico.
Se alla visita si rileva linfoadenomegalia dei linfonodi egionali è opportuno sospettare un possibile coinvolgimento metastatico. Bisogna ricordare che in caso di presenza di tumori mammari il normale drenaggio linfatico delle ghiandole mammarie può essere alterato, pertanto possono essere coinvolti, oltre ai linfonodi ascellari e inguinali superficiali, anche quelli sternali, iliaci mediali e poplitei a seconda della posizione del tumore primario.
Possono essere già presenti sintomi sistemici quando ci sono già metastasi in altri organi, come polmone, fegato, rene, milza e ossa.
Tumori maligni: Carcinomi
I carcinomi si caratterizzano per la differente reazione stromale che possono avere. Lobuli precancerosi e iperplasia duttale sono ritrovati alla periferia del nodulo canceroso, nei tessuti adiacenti, sia nei cani (73,6%) che nei gatti (56,3%).
Macroscopicamente il carcinoma è caratterizzato da una crescita rapida (può raddoppiare il volume in poco tempo), con invasione locale e infiltrazione nei tessuti circostanti. La pelle si può ulcerare frequentemente e il tumore può invadere i vasi linfatici e i linfonodi, la pelle e le ghiandole adiacenti dello stesso lato.
Le neoplasie mammarie possono avere un diametro variabile dai 2 ai 20 cm e possono essere rotondeggianti, ovoidali, fungiformi o con forme non definite. Il tumore si estende rapidamente e può occupare l’intera ghiandola, come le ghiandole adiacenti, e il carcinoma può coesistere con un tumore benigno nella stessa ghiandola o in quelle vicine.
Carcinoma in situ (non infiltrante). Si tratta di un tessuto neoplastico organizzato in noduli ben definiti che non si estendono oltre la membrana basale nel tessuto mammario circostante, con un’alta densità cellulare, costituiti da cellule molto vicine che si organizzano in tutubli irregolari. Spesso sono lesioni non visibili macroscopicamente e possono far parte di alterazioni fibrocistiche oppure essere individuate come reperti occasionali. Può essere difficile differenziarlo dall’iperplasia lobulare.
Carcinoma complesso. E’ una neoplasia comune nel cane composta sia da cellule epiteliali sia da cellule mio epiteliali. Le cellule epiteliali possono disporsi a formare neoplasie papillari, tubulari e tubulo papillari. Le cellule mio epiteliali formano reticoli e sono immerse in una matrice mucoide. Queste neoplasie si espandono nel tessuto connettivo circostante, ma solo il 10 % invade i vasi linfatici e le metastasi sono rare, con sopravvivenza di circa 10-12 mesi.
Carcinoma semplice. E’ una neoplasia composta da un solo tipo cellulare e, secondo la morfologia, si può classificare come tubulare, papillare, tubulo papillare, solido e anaplastico. Questo carcinoma tende ad invadere il tessuto circostante ed i vasi linfatici.
- Carcinoma semplice tubulare: è molto comune nel cane, questa neoplasia mantiene la struttura duttale o tubulare. Le cellule maligne che rivestono i tubuli sono pleomorfe con nuclei ipercromatici e quantità variabili di citoplasma. Lo stroma fibrovascolare è spesso infiltrato da linfociti e plasmacellule, ma anche da cellule neoplastiche.
- Carcinoma semplice papillare. Neoplasia maligna caratterizzata da proliferazioni papillari all’interno dei lumi tubulari, sorrette da uno stroma fibrovascolare. Le cellule neoplastiche possono presentare le caratteristiche descritte per il carcinoma tubulare.
- Carcinoma solido. Le cellule si organizzano in gruppi solidi, cordoni o masse, senza un lume. Spesso si identificano aree di necrosi al centro dei lobuli neoplastici, tipo comedone (comedocarcinoma). Le cellule presentano vari gradi di pleomorfismo cellulare e nucleare ed un numero variabile di figure mitotiche. Spesso si osservano cellule singole ed isolette neoplastiche infiltranti i vasi linfatici, con metastasi ai linfonodi regionali. Una variante del carcinoma semplice solido è il carcinoma cribriforme, più frequente nel gatto, che si caratterizza per la presenza di piccole aperture.
Carcinoma a cellule fusate. Le cellule neoplastiche fusate si dispongono in fasci che si incrociano e presentano moderato pleomorfismo e attività mitotica. Alcune di queste neoplasie sono composte da cellule mioepiteliali e vengono anche chiamate mioepiteliomi maligni.
Carcinoma a cellule squamose. Può originare dalle cellule duttali squamose del capezzolo e dalle cellule galattofore duttabli cubiche. Sono presenti isole e corde di cellule epiteliali squamose, che talvolta formano masse cheratiniche rotondeggianti. Le cellule e i nuclei sono grandi, eucromatici, con produzione di tono filamenti citocheratinici intraplasmatici. La cheratina stimola la produzione di una spiccata risposta infiammatoria secondaria. Può invadere i vasi linfatici, ma le metastasi a distanza sono rare. Il carcinoma adenosquamoso è considerato una variante del carcinoma squamocellulare e mostra struttura ghiandolare.
Carcinoma mucinoso. rara neoplasia mammaria, caratterizzata da cellule neoplastiche immerse in abbondante mucina PAS positiva.
Carcinoma secretorio (ricco in lipidi). Rara, composta da cellule epiteliali neoplastiche con abbondante citoplasma eosinofilico, con un unico grande vacuolo otticamente vuoto che spinge il nucleo verso la periferia. Possono essere presenti anche vacuoi più piccoli.
Tumori maligni: Sarcomi
Fibrosarcoma. Neoplasia maligna mesenchimale, composta da fibroblasti producesti collageno. Può insorgere da un tumore mammario preesistente oppure dallo stroma interstiziale della ghiandola. Presentano alcune caratteristiche morfologiche in comune con i mioepiteliomi maligni, con gli emangiopericitomi e con le neoplasie maligne del rivestimento dei nervi periferici e anche il comportamento biologico è simile.
Osteosarcoma. Questa è una neoplasia mesenchimale molto comune nelle ghiandole mammarie canine e solitamente è caratterizzata da una crescita veloce di una massa presente da molto tempo (anche anni). C’è una proliferazione di cellule che possono essere fusiformi, ovoidali o stellate, con aree di deposizione matricale osteoide e/o osso. Il comportamento biologico è simile agli osteosarcomi che insorgono in altre aree, con metastasi ematogena spesso ai polmoni.
Condrosarcoma. Non è una neoplasia molto comune e spesso si presenta in forma multi lobulata. Presente aree ben differenziate, con sparsi condrociti pleomorfi, talvolta polinucleati, inseriti in abbondante matrice condroide basofila chiara.
Carcinosarcoma. E’ abbastanza infrequente e macroscopicamente appare come una massa circoscritta spesso di consistenza dura od ossea. Sono presenti due componenti cellulari maligne, epiteliali e mesenchimali. Solitamente è aggressivo, con meta statizzazione per via linfatica ai linfonodi e polmoni della componente epiteliali e per via ematogena ai polmoni la componente mesenchimale.
Neoplasie benigne
Adenoma semplice. Può presentarsi in due varianti, adenoma tubulare semplice e adenoma solido semplice (mioepitelioma). L’adenoma tubulare semplice è costiutio da una proliferazione di strutture tubulari epiteliali che mimano i dotti interlobulari mammari. La neoplasia è multi lobulata. L’adenoma solido semplice invece è abbastanza raro, composto da cellule mioepiteliali fusiformi o stellate.
Adenoma basalioide. La massa neoplastica si ritrova spesso all’intero del lume di un dotto ectasico. Si compone di cellule organizzate in cordoni bilaterali uniformi con due distinti fronti (luminale e basale).
Adenoma complesso. In questa neoplasia è presente una proliferazione epiteliare (tubulare) e mioepiteliale. Consiste in due popolazioni cellulari e una quantità variabile di stroma. La proliferazione iniziale mioepiteliale, fusiforme e stellata, è adiacente all’epitelio duttale entro i limiti della membrana basale. All’incremento delle cellule mioepiteliali neoplastiche si accompagna l’accumulo di matrice intercellulare, con scomparsa della membrana basale.
Tumore misto benigno. In questa neoplasia è presente una proliferazione epiteliale e mioepiteliale benigna con formazione di cartilagine, osso, tessuto adiposo e midollo ematopoietico. Ci sono molte ipotesi circa l’origine della cartilagine e osso: possono risultare da metaplasia delle cellule epiteliali, metaplasia connettivale e metaplasia delle cellule mioepiteliali.
Fibroadenoma. La massa neoplastica è composta da una duplice proliferazione neoplastica epiteliale e mesenchimale senza cartilagine, osso o grasso e può essere periduttale o intraduttale. Lo stroma fibroblastico prolifera intorno ai dotti, i quali sono delimitati da un duplice strato, composto da cellule luminali epiteliali e da cellule mio epiteliali.
Papilloma duttale (adenoma papillare). Si caratterizza per una proliferazione arboriforme composta da fronde epiteliali e/o mio epiteliali sostenuta da uno stroma fibrovascolare. I dotti possono essere distesi fino alla formazione di cisti (cistadenoma papillare).
Diagnosi e stadiazione clinica
La diagnosi di neoplasia mammaria,la differenziazione tra una forma benigna e maligna ed il tipo tumorale istologico sono fondamentali per stabilire una prognosi e decidere l’approccio terapeutico. Quando viene portato un animale con noduli mammari, l’iter diagnostico corretto prevede:
ESAME OBBIETTIVO GENERALE E PARTICOLARE: indicatori di malignità solitamente sono un’elevata dimensione, una crescita rapida, ulcerazione della cute, aderenza alla cute o ai tessuti sottostanti, aumento di volume dei linfonodi tributari, presenza di noduli/masse polmonari
ESAME CITOLOGICO: semplice e veloce da eseguire. Può essere utile per distinguere tra lesioni neoplastiche, cistiche o infiammatorie. I criteri più indicativi di malignità sono anisocariosi e macrocariosi, mentre la presenza di cellule multinucleate non differenzia una neoplasia benigna da una maligna. Ha certamente delle limitazioni questa metodica: può essere difficile distinguere una neoplasia benigna da una maligna, soprattutto nel caso di un tumore ben differenziato o di un tumore a componente mista (FREQUENTI I FALSI NEGATIVI). Alcuni tumori mesenchimali possono non rilasciare cellule ed il campione citologico non sarà diagnostico. Le cellule tumorali mammarie poi si caratterizzano per l’eterogeneità morfologica e non è raro il riscontro di una popolazione predominante infiammatoria anziché neoplastica. In ultimo, la citologia non permette di valutare la presenza o l’assenza di invasione stromale, parametro importante ai fini prognostici. Non è quindi un esame affidabile e non può sostituirsi all’esame istologico.
ESAME EMOCROMOCITOMETRICO E BIOCHIMICO: frequenti sono gli aumenti della fosfatasi alcalina, secondario forse all’attività osteoblastica delle cellule neoplastiche che vanno incontro a metaplasia ossea, alla produzione di un isoenzima da parte delle cellule epiteliali o, ancora, dall’induzione dell’enzima corticosteroidi-indotto evocato dallo stress cronico.
RADIOGRAFIA del TORACE: i carcinomi mammari metastatizzano per linfatica ai linfonodi regionali, per poi raggiungere attraverso i vasi più grandi la circolazione sanguigna e i polmoni. A livello polmonare, questa metodica consente di visualizzare solamente noduli che hanno raggiunto un diametro di almeno 4 o 5 mm. In più, per evidenziare bene le piccole lesioni metastatiche è fondamentale che il polmone sia ben insufflato. Nel decubito laterale il polmone più declive è meno insufflato e può dare falsi negativi; per questo motivo sono indispensabili almeno le due proiezioni laterolaterali. Solitamente le metastasi si presentano come noduli multipli ben delineati, di varie dimensioni e sparsi a livello di parenchima. Se sono di dimensioni inferiori ai 4 mm possono avere distribuzione interstiziale diffusa. Non è raro il riscontro di un versamento pleurico.
RADIOGRAFIA ED ECOGRAFIA ADDOMINALE.
ESAME ISTOPATOLOGICO: è ancora considerata la metodica migliore ai fini diagnostici e prognostici. In aggiunta alla classificazione morfologica e al grading delle lesioni permette la rilevazione di importanti aspetti quali:
- Dettagli morfologici cellulari: forma e dimensioni cellulari e nucleari, numero di nuclei, presenza/assenza di mitosi e necrosi, aspetto della membrana basale. Più le cellule si presentano differenziate, ossia rassomiglianti il tipo cellulare originario, omogenee e regolari tra loro, più si depone a favore di una forma neoplastica benigna. Anche la presenza di una vera capsula fibroconnettivale è solitamente indicativa di una crescita di tipo benigno. Più sono presenti invece cellule poco differenziate e/o anaplastiche, pleomorfi, nuclei grandi, ipercromatici, multipli, anisocariosi, cromatina disomogenea ed irregolare, nucleoli evidenti e/o multipli, mitosi numerose e atipiche, assenza della capsula, più la diangosi verte verso la forma maligna. Il problema maggiore nella diagnosi di neoplasia mammaria canina resta l’identificazione delle neoplasie “veramente” maligne, ossia metastatizzanti, sottolineando la necessità di stavilire criteri di malignità standardizzati.
- Invasione dei tessuti circostanti e/o linfovascolare: indicatori entrambi di malignità.
- Margini di escissione: l’incompleta resezione aumenta il rischio di recidiva.
Stadiazione
Stadio I T1N0M0
Stadio II T2N0M0
Stadio III T3N0M0
Stadio IV qualsiasi T, N1M0
Stadio V qualsiasi T, qualsiasi N, M1
Alcuni dati sulle neoplasie mammarie
In letteratura veterinaria è davvero difficile trovare informazioni precise riguardo il comportamento biologico dei tumori. I motivi sono molti: innanzitutto i registri riguardanti le neoplasie canine sono recenti e spesso carenti di dati (i cani non vengono riportati ai controlli, i proprietari non sono disposti a effettuare ulteriori accertamenti…).
Sono quindi ancora poche informazioni circa l’incidenza delle varie neoplasie ed il loro sviluppo.
Uno studio molto interessante è canadese, del 1974 e analizza un totale di 13, 795 cani dal 1966 al 1971. Di questi, 6754 (il 49%) hanno presentato patologie tumorali. Di questi 729 (11%) erano a carico della mammella.
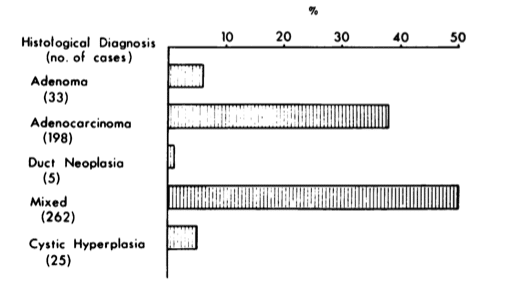
Tipo di tumore: grazie all’esame istologico possiamo vedere nel grafico la percentuale dei vari tumori.
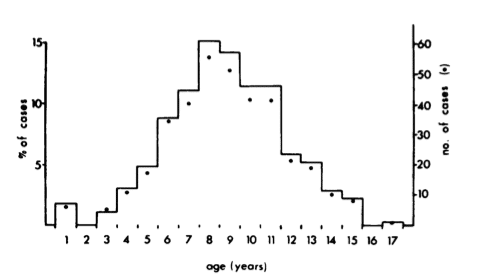
Età: come sarà confermato negli studi successivi, l’età media delle femmine affette da tumori mammari è alta (8,8 anni). L’incidenza dei tumori aumenta progressivamente dai 3 ai nove anni, diminuendo via via con l’età. Apparentemente i tumori benigni hanno un’incidenza legata all’età leggermente più bassa rispetto ai maligni: la media è di 9-10 anni per i benigni, 10-11 per i maligni. Sono relativamente rari prima dei 5 anni di età.
da MAMMARY TUMORS IN DOGS: SURVEY OF CLINICAL AND PATHOLOGICAL CHARACTERISTICS
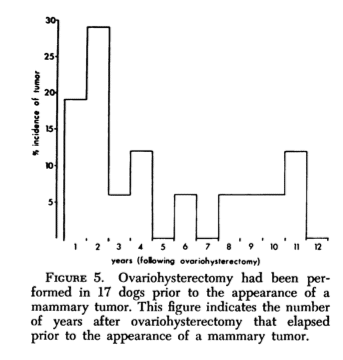
Sesso: la maggior parte dei casi erano femmine intere o sterilizzate al momento della rimozione del tumore. In 17 casi su 357 l’ovaristerectomia era stata fatta prima della presenza del tumore. Per alcuni studiosi anche le pluripare hanno un fattore di protezione nei confronti del tumore mammario, ma non tutti sono d’accordo su questo punto. Non è ancora chiaro il significato della sterilizzazione durante l’intervento.
Localizzazione: l’incidenza maggiore è nelle mammelle inguinali (36%). Le altre mammelle sono colpite più o meno in maniera uniforme. Nel 37 % dei casi i noduli erano su più mammelle.
Recidiva. L’analisi dell’influenza dell’ovaristerectomia è stata condotta in 108 casi in cui il tumore è stato rimosso chirurgicamente. In 49 di questi casi l’ovaristerectomia è stata fatta nello stesso momento dell’asportazione del tumore. I tumori sono riapparsi nel 32% dei 108 casi. In aggiunta, il tumore è ricomparso in 21 dei 49 casi sterilizzati insieme all’intervento e in 13 dei 59 casi in cui è stato asportato solo il tumore.
Terapia chirurgica
La terapia per elezione è da sempre l’asportazione chirurgica per la maggior parte dei tumori mammari, ad eccezione delle neoplasie inoperabili altamente metastatiche. L’escissione chirurgica consente una diagnosi istologica. I cani con tumori benigni e circa il 50 % di quelli con tumori maligni possono essere trattati chirurgicamente. Il restante 50 % dei pazienti con tumori maligni hanno già micro o macrometastasi nel momento dell’intervento e molti proprietari decidono di ricorrere all’eutanasia durante l’operazione.
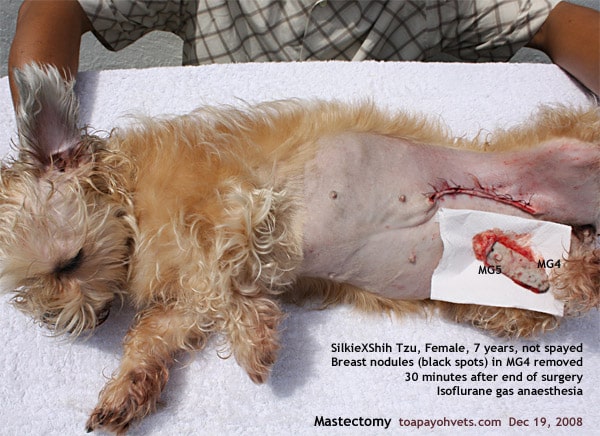
L’approccio chirurgico dipende dalla dimensione del tumore, la localizzazione e lo stato del paziente. Le tecniche possibili sono: nodulectomia, mastectomia regionale, mastectomia unilaterale o bilaterale.
| TIPO DI INTERVENTO | DESCRIZIONE | INDICATO IN CASO DI | CONTROINDICATO IN CASO DI |
| Nodulectomia | Rimozione di piccoli (< 5mm) tumori non invasivi con un cm addizionale di tessuto circostante apparentemente normale | Noduli piccoli non fissi, alla periferia della ghiandola | Lesioni multiple, segni clinici di malignità |
| Mastectomia regionale | Resezione della ghiandola interessata, quelle connesse e dei linfonodi regionali | Tumore in MG1 o MG2: resezione delle ghiandole toraciche e addominali craniali
Tumore in MG4 o MG5: resezione delle ghiandole addominali e inguinali. | |
| Mastectomia unilaterale | Rimozione del tumore con tutta la fila mammaria ipsilaterale | Tumori multipli nella stessa linea
Tumori in MG3 | |
| Mastectomia bilaterale | Rimozione di tutto il tessuto mammario | Tumori multipli nelle due linee mammarie | Non è raccomandata a causa della tensione delle ferite. Si preferisce fare prima una fila e poi operare l’altra a distanza di almeno una settimana |
da Canine Mammary Tumours, an Overview
Studi non recentissimi mostravano che il tipo di intervento non influiva sul tasso di recidiva o sul tempo di sopravvivenza se il tumore veniva tolto interamente e con margini puliti. Invece Uno studio più recente ha mostrato che la recidiva è più facile dopo interventi minimi.
In interventi di mastectomia unilaterale o regionale interessanti le ghiandole inguinali, solitamente si rimuovono anche i linfonodi superficiali. Anche se l’asportazione dei linfonodi ascellari è consigliabile quando sono affette le prime ghiandole, solitamente non si fa a causa della difficoltà di accesso.
Le letteratura mostra risultati contraddittori circa i benefici della gonadectomia nel momento di escissione del tumore.
Al momento della mastectomia molte cagne con neoplasie maligne hanno già micro metastasi in giro, così che la malattia andrà avanti anche se operate. Non ci sono linee guida per il trattamento oltre alla chirurgia per tumori avanzati: trattamenti adiuvanti come radioterapia, chemioterapia, desmopressina, terapie ormonali sono in fase sperimentale in medicina veterinaria. Ed è fondamentale prima di iniziare un trattamento di questo genere bilanciare i rischi e i benefici.
Altre terapie mediche
Inibitori delle Cox-2. I livelli di Cox-2 sono più alti nei tumori maligni rispetto a quelli benigni e rispetto al tessuto normale. L’utilizzo degli inibitori delle Cox-2 è stato descritto in casi di carcinoma infiammatorio. In uno studio, alcuni cani con IMC furono trattati solo con piroxicam al dosaggio di 0,3 mg/kg al giorno: è stato registrato un aumento della qualità della vita e un significato aumento del tasso di sopravvivenza rispetto ai cani trattati solo con protocolli chemioterapici. Sono tuttavia necessaria ulteriori studi per confermare questi risultati incoraggianti.
Desmopressina. Recenti ricerche hanno individuato la capacità della desmopressina di inibire le metastasi ai linfonodi e polmoni del tumore mammario. Questa sostanza è un derivato sintetico dell’ormone antidiuretico con proprietà emostatiche che è stato usato in medicina umana e veterinaria nel diabete insipido e per la malattia di von Willebrand. Due studi condotti da Hermo et al. nel 2008 e 2011 in gruppi di 21 e 28 femmine rispettivamente con tumore mammario, hanno mostrato un significativo aumento della sopravvivenza senza patologie e complessiva dopo la somministrazione di 1 microgrammo/kg di desmopressina intravenosa 30 minuti prima dell’intervento e 24 ore post intervento. In entrambi gli studi non sono stati riportati effetti collaterali. L’esatto meccanismo di quest’azione antitumorale non è ancora chiaro. Si può pensare che l’operazione e la trama tissutale possano indurre un rilascio di cellule cancerogene migranti nella circolazione. La somministrazione intravenosa di desmopressina induce un rapido rilascio di un alto numero di forme del fattore di von Willebrand dalle cellule endoteliali dei vasi. Studi recenti hanno mostrato che questo fattore è protettivo contro le cellule tumorali circolanti in un modello sui topi. Sembra che la diminuzione delle metastasi sia dovuta alla riduzione delle possibilità di aderenza tra le cellule circolanti e le cellule endoteliali dei vasi. In aggiunta, in vitro, il fattore è stato capace di provocare apostosi delle cellule tumorali. E’ possibile che altri meccanismi di azione, come un lieve effetto antiproliferativo (che è stato mostrato su linee cellulari di carcinoma mammario), possano contribuire all’effetto antimetastatico complessivo della vasopressina. Sono necessarie comunque ulteriori ricerche su questo farmaco e di trials clinici su larga scala per confermare questi risultati incoraggianti.
Radioterapia. Nel cane non è ancora stata ben descritta, ma si più pensare come metodica aggiuntiva alla resezione chirurgica in pazienti con tumori sezionati incompletamente, con patologie metastatiche o IMC. Sono stati istituiti molti protocolli per le radiazioni come trattamento palliativo di altre patologie canine, come il carcinoma nasale, il linfoma e l’osteosarcoma.
Recentemente sono state sviluppate strategie antiangiogeniche in umana. Anicorpi monoclonali contro i fattori di crescita dell’endotelilo vasale sono una di queste nuove terapie (es. bevacizumab). Questi anticorpi hanno un effetto antiangiogenico e perciò un effetto antitumorale in donne con un cancro alla mammella localmente avanzato o un cancro infiammatorio. Non ci sono informazioni sull’utilizzo di questi come terapia dei tumori mammari. Tuttavia, molti tumori solidi inclusi quelli mammari, inducono angiogenesi quando crescono. Questi numerosi nuovi vasi portano ossigeno e nutrienti alle cellule tumorali e facilitano la metastatizzazione. I tumori mammari maligni sembrano avere una maggior densità di microvasi rispetto a quelli benigni. In più, sembra che i tumori maligni siano più sensibili alla terapia angiogenica.
Terapia del dolore
Il controllo del dolore nei pazienti oncologici è di primari importanza, nell’acuto quanto nel cronico.
Dolore acuto. Gli interventi chirurgici sono considerati molto dolorosi, ma la radioterapia e certi agenti chemioterapici possono esserlo in egual misura. In caso di chirurgia è opportuno iniziare con una buona analgesia preintervento. Bloccando la trasmissione e la percezione dello stimolo dolorifico prima che esso si manifesti si può ridurre la dose dell’analgesico post chirurgico. Un protocollo analgesico multimodale è raccomandato per ottenere il miglior effetto antidolorifico positivo, utilizzando un mix di farmaci (antinfiammatori non steroide, oppiacei e chetamine). Il quantitativo e il tipo di analgesico post chirurgico deve essere prescritto in base al paziente .
Dolore cronico. Il trattamento palliativo ha lo scopo di alleviare il dolore cronico nel paziente. Con la progressione della malattia è necessario adattare il protocollo farmacologico a seconda del dolore e dei fattori stressanti diversi nei vari stadi della patologia. Anche il trattamento del dolore cronico prevede l’utilizzo di diversi farmaci e può includere antinfiammatori steroidi non e differenti oppioidi. L’inclusione di altri farmaci (alfa agonisti, inibitori del reuptake della serotonina, anticonvulsivanti e antiepilettici, antidepressivi triciclici) o tecniche (blocco epidurale o per neurale, radioterapia, neurolisi ..) sono oggetto di ricerca.
Le condizioni di salute mentale dell’animale sono di fondamentale importanza. Ogni trattamento medico nel paziente oncologico deve essere supportato dal migliore benessere ambientale possibile. Nutrizione corretta, un ambiente idoneo e soprattutto la serenità dei proprietari sono fondamentali nel trattamento di pazienti affetti da patologie tumorali.
Chemioterapia
La chemioterapia ormai da decenni viene offerta alle donne operate per cancro al seno. Adesso viene proposta anche in medicina veterinaria in aggiunta alla terapia o come trattamento palliativo in cani con carcinoma infiammatorio o malattia metastatica avanzata. Le reali informazioni riguardo la dose, la tossicità e l’efficacia reale di questi farmaci . Molti composti hanno dimostrato di non avere nessuna utilità o anzi di essere molto tossici.
| CHEMIOTERAPICO | DOSE | N. PAZIENTI | RISULTATI | COLLATERALI | STUDIO |
| 5 fluorouracile e ciclofosfamide | 150 mg/mq100 mg/mq | 16 (8 solo chirurgia, 8 terapia + chirurgia) | Solo chirurgia: 6 mesiChirurgia e chemio: 24 mesi | Neutropenia lieve | Karayannopoulou et al. 2001 |
| Paclitaxel | 165 mg/mq | 25 | 20% risposta parziale20% risposta stabile | 64% reazioni allergiche nonostante antistaminici e corticosteroidi24% neutropenia medio-grave24% ha richiesto ospedalizzazione
12% morte per sepsi | Poirer et al. 2004 |
| Doxorubicina o docetaxel | 30 mg/mq30 mg/mq | 31 (19 solo chirurgia, 12 chirurgia e terapia) | Non ci sono state differenze significative nel tempo senza recidive, la comparsa di metastasi e la morte | Reazioni allergiche cutanee | Simon et al. (2006) |
| Gemcitabina | 800 mg/mq | 19 (9 solo chirurgia, 10 chirurgia e terapia) | Non ci sono state differenze significative nel tempo senza recidive, la comparsa di metastasi e la morte | Neutropenia lieve | Marconato et al. (2008) |
| Mitoxantrone e vincrisitna e ciclofosfamide | 5,5 mg/mq0,75 mg/mq200 mg/mq | 30 con IMC (23 solo palli azione, 7 chemioterapia, 7 chemioterapia) | Il tempo di sopravvivenza del gruppo con chemio è doppio ma non viene registrata la remissione della malattia | 57% tossicità gastrointestinale | Clemente et al. (2009) |
| A Doxorubicina e ciclofosfamideB Doxorubicina e ciclofosfamide e 5 fluorouacile | 30 mg/mq200 mg/mq30 mg/mq
200 mg/mq 150 mg/mq | 12 (3 con protocollo A, 1 con B e 7 piroxicam) | Significativo aumento del tasso di sopravvivenza nei cani trattati con prioxicam rispetto a quelli con chemioterapici | Disturbi emorragici | De M. Souza et al. (2009) |
| Gemcitabina e carboplatino | 2mg/kg10 mg/Kg | 37 cani con diversi tipi di carcinoma | 1 remissione completa2 parziali remissione12 stabilità della malattia per una media di 72 giorni | 32% neutropenia24% trombocitopenia73% tossicità gastrointestinale | Dominguez et al. (2009) |
L’uso della ciclofosfamide in combinazione con la 5-fluorouacile o in combinazione con mitoxantrone e vincristina, aumentano significativamente la sopravvivenza.
Combinazione tra ciclofosfamide e doxorubinia con o senza 5-fluoracile nei cani con IMC causa gravi effetti collaterali.
Alti dosaggi di paclitaxel hanno dato una parziale risposta nel 20 % dei cani con tumori mammari ma sono stati riportati livelli di tossicità inaccettabili.
Trattamenti con gemcitabine è stato ben tollerato ma non ha dato differenze significative nel tempo di recidiva, metastasi distanti rispetto al solo trattamento chirurgico in cani con IMC.
Terapie ormonali
In medicina umana vengono utilizzate differenti terapie ormonali. Alcune di queste, come l’agonista dell’ormone rilasciante l’ormone luteinizzante e gli antiestrogeni devono ancora essere studiate nel cane. Altre, come l’antagonista del progesterone sono stati studiati nella donna e possono essere utilizzati nel cane.
Il goserelin, agonista del LHRH, è un farmaco utilizzato nel cancro del seno ormone-dipendente. Riduce i livelli ormonali quasi a zero nella donna. In uno studio su 18 cagne con tumore ormonodipendenti vengono riportati risultati simili (Lombardi et al. 1999). La metà dei cani sono stati trattati con 60 microgrammi/kg di Goserelin di deposito ogni 21 giorni per 12 mesi, mentre l’altra metà , di controllo, non ha ricevuto alcun trattamento. Nei cani trattati con goserelin, i livelli di estradiolo e progesterone sono diminuiti a livello di anestro e si è ridotta la dimensione del tumore. La sopravvivenza senza recidive dopo 2 anni è stata dell’88%. Per ulteriori informazioni su questo farmaco cliccare qui
Antagonisti del progesterone (antiprogestinici) e modulatori dei recettori del progesterone (PRMs) sono stati studiati per il trattamento del cancro alla mammella della donna. Studi sperimentali su topi e ratti hanno mostrato una maggiore attività antitumorale rispetto al tamoxifene o ad alte dosi di progestinici. In più, la combinazione tra antagonisti del progesterone o PRMs con antiestrogeni hanno mostrato una maggior efficacia rispetto al trattamento con una sola sostanza. Studi clinici hanno mostrato una risposta nel 10-12% e una stabilità della patologia nel 42-46% dei casi. L’onapristone, un antagonista del progesterone, ha presentato una tossicità epatica e gli ulteriori studi sono stati bloccati. In oncologia veterinaria questo gruppo di farmaci possono avere effetti benefici: aglepristone, un bloccante dei recettori del progesterone, è utilizzato nei cani per indurre l’aborto o il parto e nel trattamento della piometra. Un recente studio (Guil-Luna et al. 2011) ha mostrato che può diminuire la proliferazione nei carcinomi mammari canini progesterone positivi. Ovviamente c’è la necessità di ricerche ulteriori su un largo numero di pazienti e la correlazione con variabili cliniche è necessaria prima dell’utilizzo dell’aglepristone come adjuvante del trattamento dei tumori.
http://www.paginesanitarie.com/skveterinari/monografia%20di%20ALIZIN%20SC%20FL%2010ML.htm
Una delle più vecchie e più utilizzate terapie ormonali nella donna è la terapia anti-estrogenica, per evitare una stimolazione ulteriore delle cellule tumorali. Il tamoxifene è il più utilizzato. Teoricamente anche i cani potrebbero avere giovamento da questo trattamento. Il tamoxifene è stato usato i trial clinici veterinari sull’effetto dell’ovariectomia al tempo della mastectomia. Gli effetti collaterali simil estrogenici (gonfiore della vulva, scoli, cambi di comportamento, piometra (moncone) sono stati riportati, ma non è stata dimostrata un’attività antitumorale. Per questo motivo, il trattamento con tamoxifene nei tumori mammari del cane non è supportato da riscontri scientifici.
Il tamoxifene merita una piccolo trafiletto. Dopo l’abbandono negli anni 70 del dietilstibesterolo (detto DES), il primo estogeno di sintesi, impiegato per anni da milioni di donne per prevenire problemi di aborto e complicazioni durante il parto, oltre che per il trattamento di acne, pillola del giorno dopo, in certi cancri al seno, che si scoprì essere cancerogeno e distruttivo per il sistema endocrino, alla fine degli anni 60 fece il suo debutto sul mercato il tamoxifen (che il DES fosse pericoloso e nocivo lo si sapeva fin dai primi test del 1938..). Il tamoxifen ha una struttura simile al DES, infatti provoca gli stessi anormali cambiamenti osservati nelle cellule delle donne che assumevano estradiolo e DES. Venne dapprima approvato dalla FDA per essere usato come pillola per il controllo delle nascite. Si dimostrò capace di indurre l’ovulazione più che di inibirla. Nonostante non funzionasse come contraccettivo, si scoprì che diminuiva il tasso di canceo alle ammelle negli animali. Impediva infatti agli estrogeni di saldarsi ai siti recettori sulle cellule dei tessuti mamamri. Si pensava così che farmaci come il tamoxifen, bloccando gli effetti degli estrogeni sul seno potessero ridurre il rischio della recidiva del cancro al seno. Questo farmaco agisce come un debole estrogeno mettendosi in competizione con i recettori per gli estrogeni più come fanno i fitoestrogeni. E’ un bloccante degli estrogeni: si aggancia ad i recettori impedendo all’estrogeno di legarsi: in questo modo viene ridotto lo sviluppo delle cellule tumorali.
Questo farmaco mostrava però due caratteristiche contraddittorie: agiva sia come estrogeno che come antiestrogeno. Mentre era un antiestrogeno per il seno, agiva come estrogeno nell’utero e in misura minore sul cuore, vasi sanguigni e ossa. Ben presto ci si rese conto della sua capacità di promuovere tumori particolarmente aggressivi all’utero e fegato.
Come per il DES in passato, l’uso del tamoxifen venne esteso come preventivo contro l’osteoporosi e i problemi cardiaci. In America viene raccomandato a tutte le donne in pre-menopausa con ormoni tumorali positivi, così come a molte donne in pre-menopausa con cancro al seno e/o un numero sempre maggiore di donne con ormoni tumorali negativi. Il Tamoxifen (nome commerciale Nolvadex) è attualmente il più prescritto farmaco per il cancro al mondo. Venne sviluppato dall’azienda britannica Imperial Chemical Industries (ICI), una delle maggiori aziende chimiche multinazionali al mondo. La Zeneca, una sussidiaria della ICI, è responsabile della produzione e commercializzazione dell’ormone ed è attualmente la maggior azienda al mondo di farmaci per il cancro. La divisione agrochimica dell’ICI, che include la Zeneca, produce clorurati e altri componenti chimici industriali compresi erbicidi. Sono tutti velenosi, e molti sono conosciuti come distruttori endocrini che sono stati accusati di provocare il cancro al seno.
Prognosi
E’ difficile riassumere le prognosi in medicina veterinaria, pochè non tutti gli studi utilizzano le stesse metodiche. Spesso la prognosi si esprime in percentuale di sopravvivenza 1 o 2 anni dopo la mastectomia o con il tempo trascorso tra la chirurgia e la morte.
La sopravvivenza può variare in maniera importante poichè dipende da caratteristiche proprie del tumore e dell’ospite, che includono età, grandezza del tumore e stadio, tipo istopatologico, comportamento clinico, interessamento dei linfonodi, espressione dei recettori per gli ormoni, espressioni delle COx-2, reazione linfonodale. Idealmente, i differenti parametri possono essere valutati in ordine per ottenere la miglior prognosi
| Fattore | Effetto sulla prognosi |
| Età | Aumento età: si abbassa il tempo di sopravvivenza senza ricadute, si abbassa il tempo di sopravvivenza
Per altri studi Aumento età: nessun effetto |
| Tipo istopatologico | Carcinoma anaplastico: 2,5 mesiCarcinoma tubulo papillare: 21 mesiCarcinoma solido: 16 mesi
Altri carcinomi: 14 mesi |
| Stadio del tumore | Stadio I: media di 24 mesiStadio II: media di 12 mesiStadio III: media di 15 mesi
Stadio IV: media di 19 mesi Stadio IV e V media di 6 mesi |
| Grado | Sopravvivenza di 2 anni nel 100% con grado I, 53,3% con grado II, 13,5% grado III |
| Metastasi ai linfonodi regionali | Dopo due anni: 85% dei cani con metastasi ai linfonodi al tempo dell’intervento è morto rispetto al 21% senza metastasi |
| Metastasi | Sopravvivenza media: cani senza metastasi al tepo dell’intervento 28 mesi, cani con metastasi 5 |
L’età avanzata alla diagnosi di tumore è associata con una diminuzione del tempo di sopravvivenza e di comparsa delle metastasi secondo alcuni studi, secondo altri non c’è grande correlazione. E’ comunque importante sottolineare che i cani più anziani hanno pià possibilità di morire per cause non tumorali rispetto ai giovani.
Dimensioni del tumore: è un fattore molto importante. Secondo alcuni studi la media di sopravvivenza con un diametro sotto i 3 cm è dai 14 ai 22 mesi. Se è superiore ai 3 cm per la medicina tradizionale la prognosi è spesso infausta.
La possibilità che il tumore sia maligno aumenta con l’aumentare della taglia. I linfonodi solitamente sono intaccati quando il tumore è superiore ai 5 cm.
L’invasione dei tessuti circostanti e l’ulcerazione sono solitamente associati a malignità.
